Pengertian Sifat Koligatif Larutan
Sifat koligatif larutan adalah sifat fisik larutan yang hanya bergantung pada jumlah partikel zat terlarut.
Sebelum mempelajari lebih lanjut, kita harus mengetahui jenis-jenis konsentrasi larutan terlebih dahulu, karena dalam perhitungannya akan banyak melibatkan rumus-rumus konsentrasi.
Berikut ini adalah beberapa jenis konsentrasi larutan.
3. Fraksi mol (X), adalah perbandingan mol bagian dengan mol seluruh komponen.
Fraksi mol pelarut (Xp)
Fraksi mol terlarut (Xt)
Sifat koligatif larutan meliputi empat sifat, yaitu :
Penurunan tekanan uap (∆P)
Kenaikan titik didih (∆Tb)
Penurunan titik beku (∆Tf)
Tekanan osmotik (π)
Selanjutnya mari kita bahas satu per satu.
Penurunan Tekanan Uap (∆P)
Tekanan uap dari cairan murni bergantung pada jumlah molekul yang meninggalkan fase cair menjadi fase uap.
Jumlah partikel zat terlarut yang ditambahkan dalam cairan murni akan menjadi penghalang molekul cairan murni yang akan meninggalkan fase cair sehingga tekanan uap cairan murni (P⁰) lebih besar dari tekanan uap larutan (P).
Hal itu menunjukkan bahwa telah terjadi penurunan tekanan uap (∆P).
Kenaikan Titik Didih (∆Tb)
Jika partikel zat terlarut ditambahkan dalam suatu pelarut, maka akan menyebabkan kenaikan titik didih (∆Tb), dimana titik didih larutan (Tblarutan) lebih besar dari titik didih pelarut (Tbpelarut).
Penurunan Titik Beku (∆Tf)
Jika zat terlarut ditambahkan dalam suatu pelarut, maka akan menyebabkan penurunan titik beku (∆Tf), dimana titik beku pelarut (Tfpelarut) lebih besar dari titik beku larutan (Tflarutan).
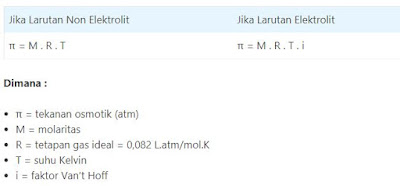
Tekanan Osmotik (π)
Osmosis adalah peristiwa berpindahnya zat pelarut dari larutan yang lebih encer ke larutan yang lebih pekat melalui membran semipermeabel.
Berdasarkan tekanan osmosik larutan, larutan terbagi menjadi tiga, yaitu :
1. Larutan isotonik, adalah larutan yang memiliki tekanan osmotik sama.
2. Larutan hipertonik, adalah larutan yang memiliki tekanan osmotik lebih besar.
3. Larutan hipotonik, adalah larutan yang memiliki tekanan osmotik lebih kecil.













Keren Pak...mantap, cuma saya belum lihat soalnya Pak, kunjungi blog saya ya
BalasHapus