Rabu, 13 Mei 2020
Kamis, 07 Mei 2020
Sifat Koligatif Larutan
Pengertian Sifat Koligatif Larutan
Sifat koligatif larutan adalah sifat fisik larutan yang hanya bergantung pada jumlah partikel zat terlarut.
Sebelum mempelajari lebih lanjut, kita harus mengetahui jenis-jenis konsentrasi larutan terlebih dahulu, karena dalam perhitungannya akan banyak melibatkan rumus-rumus konsentrasi.
Berikut ini adalah beberapa jenis konsentrasi larutan.
3. Fraksi mol (X), adalah perbandingan mol bagian dengan mol seluruh komponen.
Fraksi mol pelarut (Xp)
Fraksi mol terlarut (Xt)
Sifat koligatif larutan meliputi empat sifat, yaitu :
Penurunan tekanan uap (∆P)
Kenaikan titik didih (∆Tb)
Penurunan titik beku (∆Tf)
Tekanan osmotik (π)
Selanjutnya mari kita bahas satu per satu.
Penurunan Tekanan Uap (∆P)
Tekanan uap dari cairan murni bergantung pada jumlah molekul yang meninggalkan fase cair menjadi fase uap.
Jumlah partikel zat terlarut yang ditambahkan dalam cairan murni akan menjadi penghalang molekul cairan murni yang akan meninggalkan fase cair sehingga tekanan uap cairan murni (P⁰) lebih besar dari tekanan uap larutan (P).
Hal itu menunjukkan bahwa telah terjadi penurunan tekanan uap (∆P).
Kenaikan Titik Didih (∆Tb)
Jika partikel zat terlarut ditambahkan dalam suatu pelarut, maka akan menyebabkan kenaikan titik didih (∆Tb), dimana titik didih larutan (Tblarutan) lebih besar dari titik didih pelarut (Tbpelarut).
Penurunan Titik Beku (∆Tf)
Jika zat terlarut ditambahkan dalam suatu pelarut, maka akan menyebabkan penurunan titik beku (∆Tf), dimana titik beku pelarut (Tfpelarut) lebih besar dari titik beku larutan (Tflarutan).
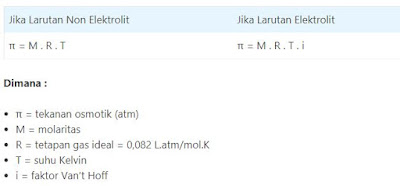
Tekanan Osmotik (π)
Osmosis adalah peristiwa berpindahnya zat pelarut dari larutan yang lebih encer ke larutan yang lebih pekat melalui membran semipermeabel.
Berdasarkan tekanan osmosik larutan, larutan terbagi menjadi tiga, yaitu :
1. Larutan isotonik, adalah larutan yang memiliki tekanan osmotik sama.
2. Larutan hipertonik, adalah larutan yang memiliki tekanan osmotik lebih besar.
3. Larutan hipotonik, adalah larutan yang memiliki tekanan osmotik lebih kecil.
Pergeseran Kesetimbangan Kimia
Pergeseran Kesetimbangan dapat terjadi karena dipengaruhi beberapa faktor. Menurut asas Le Chatelier sendiri sebagai ilmuwan, Jika sutu sistem kesetimbangan diberikan aksi-aksi tertentu, maka sistem akan mengadakan reaksi yang cenderung menghilangkan pengaruh aksi yang diberikan. Cara sistem bereaksi adalah dengan melakukan pergeseran, baik ke kanan maupun ke kiri.
Berikut ini faktor-faktor yang mempengaruhi pergeseran kesetimbangan, yaitu:
1. Faktor Konsentrasi; jika konsentrasi reaksi diperbesar, maka kesetimbangan reaksi akan bergeser ke kanan begitupun sebaliknya
2. Faktor Tekanan; jika tekanan reaksi diperbesar tetapi volume diperkecil, pergeseran kesetimbangan reaksi akan menuju ke arah bagian yang jumlah koefisiennya kecil,
3. Faktor Suhu; jika suhu suatu sistem dinaikkan, maka sistem akan bereaksi dengan menurunkan suhu, kesetimbangan akan bergeser ke bagian reaksi yang menyerap kalor atau dikenal dengan reaksi endoterm. Begitupun sebaliknya, jika suhu diturunkan maka kesetimbangan akan bergeser ke bagian yang melepaskan kalor atau disebut dengan reaksi eksoterm.
4. Faktor Katalis; Katalis itu sendiri adalah sebuah zat yang dapat mempercepat reaksi namun akan kembali ke wujudnya semula ketika reaksi telah selesai. Katalis dapat memperbesar laju reaksi karena menurunkan energi aktivasi. Dengan menggunakan katalis, suatu reaksi dapat dijadikan berjalan lambat ataupun cepat, sesuai yang dibutuhkan. Katalis juga penting untuk reaksi yang berlangsung pada suhu tinggi karena dengan menggunakan katalis maka reaksi dapat diatur agar tetap berlangsung pada suhu rendah. Jadi katalis ini tidak menggeser kesetimbangan tapi hanya mempercepat terjadinya kestimbangan
Semoga bermanfaat, ayo selalu semangat belajar
Pengertian, Jenis, dan Sifat Koloid
Pengertian Koloid
Pengertian koloid adalah campuran heterogen dari dua zat atau lebih di mana partikel-partikel zat berukuran antara 1 hingga 1000 nm terdispersi (tersebar) merata dalam medium zat lain. Zat yang terdispersi sebagai partikel disebut fase terdispersi, sedangkan zat yang menjadi medium mendispersikan partikel disebut medium pendispersi. Secara makroskopis, koloid terlihat seperti larutan, di mana terbentuk campuran homogen dari zat terlarut dan pelarut. Namun, secara mikroskopis, terlihat seperti suspensi, yakni campuran heterogen di mana masing-masing komponen campuran cenderung saling memisah.
Jenis-jenis Koloid
Sistem koloid dapat dikelompokkan berdasarkan fase terdispersi dan fase pendispersinya. Berdasarkan fase terdispersi, jenis koloid ada tiga, antara lain sol (fase tersispersi padat), emulsi (fase terdispersi cair), dan buih (fase terdispersi gas). Koloid dengan fase pendispersi gas disebut aerosol. Berdasarkan fase terdispersi dan pendispersinya, jenis koloid dapat dibagi menjadi 8 golongan seperti pada tabel berikut.
Sifat-sifat Koloid
1.Efek Tyndall
Ketika seberkas cahaya diarahkan kepada larutan, cahaya akan diteruskan. Namun, ketika berkas cahaya diarahkan kepada sistem koloid, cahaya akan dihamburkan. Efek penghamburan cahaya oleh partikel koloid ini disebut efek Tyndall. Efek Tyndall dapat digunakan untuk membedakan sistem koloid dari larutan. Penghamburan cahaya ini terjadi karena ukuran partikel koloid hampir sama dengan panjang gelombang cahaya tampak (400 – 750 nm).
2. Gerak Brown
Secara mikroskopis, partikel-partikel koloid bergerak secara acak dengan jalur patah-patah (zig-zag) dalam medium pendispersi. Gerakan ini disebabkan oleh terjadinya tumbukan antara partikel koloid dengan medium pendispersi. Gerakan acak partikel ini disebut gerak Brown. Gerak Brown membantu menstabilkan partikel koloid sehingga tidak terjadi pemisahan antara partikel terdispersi dan medium pendispersi oleh pengaruh gaya gravitasi.
3.Muatan koloid
a. Adsorpsi
Partikel koloid dapat menyerap partikel-partikel lain yang bermuatan maupun tidak bermuatan pada bagian permukaannya. Peristiwa penyerapan partikel-partikel pada permukaan zat ini disebut adsorpsi. Partikel koloid dapat mengadsorpsi ion-ion dari medium pendispersinya sehingga partikel tersebut menjadi bermuatan listrik. Jenis muatannya bergantung pada muatan ion-ion yang diserap. Sebagai contoh, sol Fe(OH)3 dalam air bermuatan positif karena mengadsorpsi ion-ion positif, sedangkan sol As2S3 bermuatan negatif karena mengadsorpsi ion-ion negatif.
b. Elektroforesis
Partikel koloid dapat bergerak dalam medan listrik. Hal ini menunjukkan bahwa partikel koloid bermuatan listrik. Pergerakan partikel koloid dalam medan listrik di mana partikel bermuatan bergerak ke arah elektrode dengan muatan berlawanan ini disebut elektroforesis. Koloid bermuatan positif akan bergerak ke arah elektrode negatif, sedangkan koloid bermuatan negatif akan bergerak ke arah elektrode positif. Oleh karena itu, elektroforesis dapat digunakan untuk menentukan jenis muatan koloid dan juga untuk memisahkan partikel-partikel koloid berdasarkan ukuran partikel dan muatannya.
4. Koagulasi
Muatan listrik sejenis dari partikel-partikel koloid membantu menstabilkan sistem koloid. Jika muatan listrik tersebut hilang, partikel-partikel koloid akan menjadi tidak stabil dan bergabung membentuk gumpalan. Proses pembentukan gumpalan-gumpalan partikel ini disebut koagulasi. Setelah gumpalan-gumpalan ini menjadi cukup besar, gumpalan ini akhirnya akan mengendap akibat pengaruh gravitasi. Koagulasi dapat dilakukan dengan empat cara, yaitu:
1.mekanik, yakni dengan pengadukan, pemanasan atau pendinginan;
2.menggunakan prinsip elektroforesis, di mana partikel-partikel koloid bermuatan negatif akan digumpalkan di elektrode positif dan partikel-partikel koloid bermuatan positif akan digumpalkan di elektrode negatif jika dialirkan arus listrik cukup lama;
3.menambahkan elektrolit, di mana ion positif dari elektrolit akan ditarik partikel koloid bermuatan negatif dan ion negatif dari elektrolit akan ditarik partikel koloid bermuatan positif sehingga partikel-partikel koloid dikelilingi oleh lapisan kedua yang memiliki muatan berlawanan dengan lapisan pertama. Apabila jarak antara kedua lapisan tersebut cukup dekat, muatan partikel koloid akan menjadi netral sehingga terjadilah koagulasi. Semakin besar muatan ion dari elektrolit, proses koagulasi semakin cepat dan efektif;
4.menambahkan koloid lain dengan muatan berlawanan, di mana kedua sistem koloid dengan muatan berlawanan akan saling tarik-menarik dan saling mengadsorpsi sehingga terjadi koagulasi.
Koagulasi dapat dicegah dengan penambahan koloid pelindung, yakni suatu koloid yang berfungsi menstabilkan partikel koloid yang terdispersi dengan membungkus partikel tersebut sehingga tidak dapat saling bergabung membentuk gumpalan.
Jumat, 24 April 2020
Al quran dan Ilmu kimia
Al quran adalah kitab suci umat islam yang telah di turunkan 14 abad yang lalu, Al quran bukan buku ilmiah. Akan tetapi, kitab ini mencakup beberapa penjelasan ilmiah dalam tautan keagamaannya.
Penjelasan ini tidak pernah bertentangan dengan temuan-temuan ilmu modern. Sebaliknya, fakta-fakta tertentu yang baru ditemukan dengan teknologi abad ke-20 itu sebenarnya telah diungkapkan dalam Al quran 14 abad silam.
Ini menunjukkan bahwa Al quran merupakan salah satu bukti terpenting yang menegaskan keberadaan Allah.
Penjelasan ini tidak pernah bertentangan dengan temuan-temuan ilmu modern. Sebaliknya, fakta-fakta tertentu yang baru ditemukan dengan teknologi abad ke-20 itu sebenarnya telah diungkapkan dalam Al quran 14 abad silam.
Ini menunjukkan bahwa Al quran merupakan salah satu bukti terpenting yang menegaskan keberadaan Allah.
Ilmu kimia yang merupakan salah satu dari cabang penjurusan ilmu pengetahuan alam, suatu ilmu yang menjelaskan struktur perubahan dari suatu objek setara, yang di akibatkan oleh suatu reaksi. Ternyata, pengetahuan kimia tersebut telah diungkapkan dalam Al quran sejak zaman dulu. Adapun penjelasan secara detail nya, baru bisa dijelaskan pada zaman baru-baru ini.
Keseimbangan dalam atom
لَا الشَّمْسُ يَنْبَغِي لَهَا أَنْ تُدْرِكَ الْقَمَرَ وَلَا اللَّيْلُ سَابِقُ النَّهَارِ وَكُلٌّ فِي فَلَكٍ يَسْبَحُونَ
“Tidaklah mungkin bagi matahari mengejar bulan dan malam pun tidak mungkin mendahului siang. Masing-masing beredar pada garis edarnya. (Qs. Yaasin : 40)
Sebuah atom dan pergerakannya, merupakan miniatur dari pergerakan galaksi kita. Kita perlu meninjau lebih jauh ke perincian tentang struktur sempurna yang berada di dalam sebuah atom. Seperti yang Anda ketahui, elektron terus berputar mengelilingi inti atom karena muatan listriknya. Semua elektron bermuatan negatif (-) dan semua proton bermuatan positif (+). Muatan positif (+) dari inti atom menarik elektron kepadanya. Karena alasan ini, elektron tidak meninggalkan inti, meskipun ada gaya sentrifugal (yang menarik elektron menjauhi inti) yang terjadi akibat kecepatan elektron.
وَمِنْ كُلِّ شَيْءٍ خَلَقْنَا زَوْجَيْنِ لَعَلَّكُمْ تَذَكَّرُونَ
“Dan segala sesuatu Kami ciptakan berpasang-pasangan agar kamu mengingat kebesaran Allah”.(Qs. Az-zariat : 49)
Atom memiliki elektron di bagian luarnya dan proton dalam jumlah sama di bagian pusatnya. Maka, muatan listrik atom berada dalam keadaan seimbang. Namun, baik volume maupun massa proton lebih besar daripada elektron. Jika kita membandingkannya, perbedaan di antara kedua partikel ini adalah seperti perbedaan antara manusia dengan sebutir kacang kenari. Walaupun demikian, muatan listrik total keduanya tetap sama besar.
Dengan demikian, dalam Al quran di sana-sini kita temukan ayat-ayat yang mendorong pembacanya untuk melakukan penelitian lebih lanjut dalam berbagai bidang ilmu pengetahuan, termasuk ilmu kimia.